Cuando se desean separar los componentes de una mezcla, es necesario conocer l tipo de mezcla que se va a utilizar, antes de seleccionar el método que se va a emplear. Una forma de agrupar las mezclas es la siguiente: mezclas de sólidos, mezclas de solido con líquido y mezclas de líquidos entre sí.
SEPARACION DE MEZCLAS DE SOLIDOS
Se emplean básicamente dos métodos: la separación manual o tamizado y la levigación.
ü LA SEPARACION MANUAL O TAMIZADO
Se utiliza cuando la mezcla está formada por partículas de diferentes tamaños. El instrumento utilizado se llama tamiz, consta de un cedazo, de un recipiente y su tapa. Este método es muy utilizado en el análisis de suelos y en la industria de las harinas. BIBLIOGRAFIA
LIBRO: Hacia La Quimica 1
AUTORES:
•Arcesio Garcia R.
•Aquilino Audab L.
•Ruben P. PAGINAS:
30, 31, 32, 33,34 Y 35.
30, 31, 32, 33,34 Y 35.
EDITORAL:
ANDINO
ANDINO
NOMBRE DEL TEXTO:
Metodos De Separacion De Sustancias.
Metodos De Separacion De Sustancias.
BIBLIOGRAFIA 2
LIBRO: Quimica Inorganica
EDITORIAL: Santillana
PAGINAS: 23-25
AUTORES:
* Cesar Humberto Mondragon Martinez
* Luz Yadira Peña Gomez* Martha Sanchez De Escobar
* Fernando Arbelaez Escalante
EDITORIAL: Santillana
PAGINAS: 23-25
AUTORES:
* Cesar Humberto Mondragon Martinez
* Luz Yadira Peña Gomez* Martha Sanchez De Escobar
* Fernando Arbelaez Escalante

ü LA LEVIGACION
Consiste en pulverizar la mezcla sólida y tratarla luego con disolventes apropiados, basándose en su diferencia de densidad. Este método es muy empleado en la minería especialmente en la separación de oro.
ü LA IMANTACION O SEPARACION MAGNETICA
Consiste en separar metales y no metales, utilizando un campo magnético (imán).

SEPARACION DE MEZCLAS SOLIDO-LIQUIDO
Con este propósito se pueden utilizar los siguientes métodos:
ü LA DECANTACION
Este método se basa en la diferencia de densidad de las sustancias que componen la mezcla. Para separar una mezcla de un sólido con un líquido, se pone la mezcla en un recipiente y se deja en reposo por algún tiempo, hasta que el sólido se precipite, es decir, se deposite en el fondo del recipiente. Como casi siempre queda una pequeña parte de líquido en la parte solida se puede terminar la separación por evaporación

http://mediateca.educa.madrid.org/imagen/ver.php?id_imagen=d4ihgq8fnzlpfzrd

http://mediateca.educa.madrid.org/imagen/ver.php?id_imagen=d4ihgq8fnzlpfzrd
ü LA FILTRACION
Consiste en pasar la mezcla por un filtro. El filtro es un material poroso de papel especial que deja pasar por los poros el líquido y retiene las sustancias en estado sólido que se encuentran en forma de grano grueso o polvo muy fino.
En un filtración se llama residuo lo que queda en el papel filtro, y filtrado a lo que pasa a través de este.
La filtración es un método muy empleado en el laboratorio, en la industria y en el tratamiento de aguas residuales.
ü LA CENTRIFUGACION
Consiste esencialmente en someter la mezcla a la acción de la fuerza centrífuga, haciendo girar el recipiente con la mezcla a gran velocidad, con esto el sólido se deposita en el fondo del recipiente, mientras que el componente liquido queda como un sobrenadante que se puede separar fácilmente por decantación. Este método es muy empleado en química analítica, en la industria y en el laboratorio clínico.

SEPARACION DE MEZCLAS DE LIQUIDOS
Para realizar esta separación se puede usar la destilación simple, la filtración fraccionada y la cromatografía.
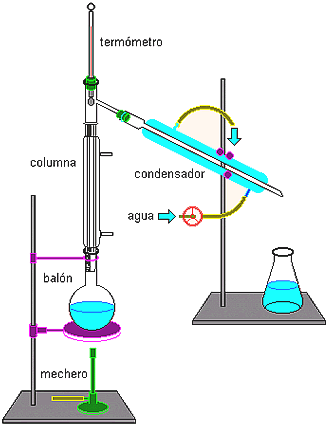
ü DESTILACION SIMPLE
Se fundamenta en la diferencia en los puntos de ebullición de los componentes dela mezcla. Por calentamiento se hace que el líquido de más bajo punto de ebullición se evapore primero, para luego recogerlo haciendo pasar sus vapores por un medio refrigerado llamado refrigerante o condensador.
ü DESTILACION FRACCIONADA
Es empleada cuando se requiere hacer la separación de una mezcla que está formada por varios líquidos cuyos puntos de ebullición son diferentes pero muy próximos entre sí. Este procedimiento es empleado en la industria del petróleo. El líquido con punto de ebullición más bajo, saldrá primero convertido en vapor, el cual se condensa al pasar por un refrigerante y posteriormente se recoge en un recipiente; la temperatura se controla mediante un termómetro. Este procedimiento se repite varias veces hasta aislar todos los componentes de una mezcla.
ü CROMATOGRAFIA
Las primeras investigaciones sobre cromatografía fueron realizadas entre 1903 y 1906 por el botánico MIKHAILO TSWETT.
Tswett separo pigmentos de las hijas de las plantas por cromatografía en columna. Primero disolvió los pigmentos de las hojas en éter de petróleo, u liquido similar a la gasolina; luego, los hizo pasar a través de una columna de vidrio empacada con carbonato de calcio pulverizado, y finalmente, lavo la columna vertiendo en ellas más éter de petróleo.
Tswett observo que los diferentes pigmentos se repartirían a lo largo de la columna formando bandas coloreadas; estas bandas, cada 7una de las cuales contenía un pigmento puro, se separaban a medida que se movía mas debajo de la columna, de modo que se podían obtener pigmentos puros. El nombre cromatografía se originó de esta primera separación de sustancias coloridas aunque la técnica no se limita a sustancias coloridas.
Tswett separo pigmentos de las hijas de las plantas por cromatografía en columna. Primero disolvió los pigmentos de las hojas en éter de petróleo, u liquido similar a la gasolina; luego, los hizo pasar a través de una columna de vidrio empacada con carbonato de calcio pulverizado, y finalmente, lavo la columna vertiendo en ellas más éter de petróleo.
Tswett observo que los diferentes pigmentos se repartirían a lo largo de la columna formando bandas coloreadas; estas bandas, cada 7una de las cuales contenía un pigmento puro, se separaban a medida que se movía mas debajo de la columna, de modo que se podían obtener pigmentos puros. El nombre cromatografía se originó de esta primera separación de sustancias coloridas aunque la técnica no se limita a sustancias coloridas.
La cromatografía es entonces un método analítico empleado en la separación, identificación y determinación de los componentes químicos en mezclas complejas.
Aunque puede resultar difícil definir con rigor el término cromatografía ya que el concepto se ha aplicado a una gran variedad de sistemas y técnicas, se puede decir que todos estos métodos tienen en común el empleo de una fase estacionaria y una fase móvil. Los componentes de una mezcla son llevados a través de la fase estacionaria por el flujo de una fase móvil gaseosa o liquida. Las separaciones están basadas en las diferencias en la velocidad de migración entre los componentes de la muestra.


ü FASE ESTACIONARIA
Se encuentra empacada en un tubo o columna y puede ser un sólido poroso o un líquido poco volátil a la temperatura de la columna y uniforme distribuido sobre y un soporte solido inerte.
ü FASE MOVIL
En cromatografía liquida, es un líquido que fluye continuamente a través de la columna y arrastra en su paso la muestra por separar; puede ser un solvente puro o una mezcla de ellos.
· LA CROMATOGRAFIA DE PAPEL
Utiliza como absorbente papel filtro, en él se coloca la mezcla que va a separar y se pone en contacto con el disolvente. Una vez corrido el disolvente. Una vez corrido el disolvente, se retira el papel y se deja secar.